Cookies
Nuestro sitio web utiliza cookies para mejorar su experiencia de navegación. Al continuar su navegación, se considera su acuerdo con nuestra política de usarlos. Para obtener más información, consulte nuestra Política de cookies.

Para aumentar o disminuir la fuente, use los atajos nativos de su navegador.
En Windows Control + (para aumentar) y Control- (para disminuir)
En MacOS (Safari) cmd + (para aumentar) y cmd- (para disminuir)

Preguntas y Respuestas
Aquí usted encuentra las preguntas frecuentes enviadas por los consumidores. En el caso que tenga alguna duda, entre en contacto con nuestro SAC 0800 701 1918 o sac@cristalia.com.br
¿Qué es un lote?
Es la cantidad de un medicamento o producto que se produce en un ciclo de fabricación, cuya característica esencial es la homogeneidad.
¿Qué es un número de lote?
Es la designación que se imprime en la etiqueta de los productos, que permite identificar al lote que pertenece y, si es necesario, localizar y revisar todas las operaciones de fabricación e inspección practicadas durante la producción.
¿Cómo es el formato del número de lote de Cristália?
El número de lote de Cristália tiene ocho dígitos; los primeros cuatro corresponden al año y mes de fabricación respectivamente, y los últimos cuatro al número de serie de producto, como en el siguiente ejemplo:
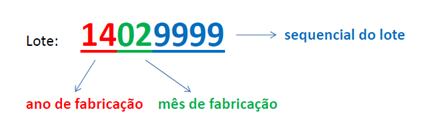 Fuente: Cristália
Fuente: Cristália
¿Qué es un medicamento biológico?
Los medicamentos biológicos son moléculas complejas de alto peso molecular que se obtienen a partir de fluidos biológicos, tejidos de origen animal o procedimientos biotecnológicos mediante la manipulación o la inserción de otro material genético (tecnología de ADN recombinante) o la alteración de los genes que se produce por irradiación, productos químicos o selección forzada. Debido a que muchos productos se pueden clasificar como biológicos, se ha vuelto imprescindible establecer los límites del alcance de la norma que regula el registro de estos medicamentos, con el fin de que las particularidades de cada categoría puedan ser mejor evaluadas y especificadas en la legislación. Actualmente, la legislación de registro de medicamentos biológicos abarca las siguientes categorías:
Alérgenos: son sustancias, generalmente de origen proteico, que se encuentran en los animales o las plantas y que pueden inducir una respuesta IgE o una reacción alérgica de tipo I.
Anticuerpos monoclonales: son inmunoglobulinas derivadas de un mismo clon de linfocitos B, que se clonan y propagan en líneas celulares continuas.
Biomedicamentos: son medicamentos que se obtienen a partir de fluidos biológicos o de tejidos de origen animal o medicamentos que se obtienen a través de procedimientos biológicos.
Productos derivados de la sangre: son productos farmacéuticos que se obtienen a partir del plasma humano, que se someten a procesos de industrialización y normalización que les confieren calidad, estabilidad, actividad y especificidad.
Probióticos: son preparaciones o productos que contienen microorganismos definidos y viables en cantidad suficiente para alterar la microbiota, por implantación o colonización de un compartimento del huésped y, por lo tanto, tienen un efecto beneficioso en la salud de ese huésped.
Vacunas: son medicamentos inmunobiológicos que contienen una o más sustancias antigénicas que, al inocularse, pueden inducir la inmunidad específica activa, con el fin de proteger contra la enfermedad o enfermedades causadas por el agente que originó el antígeno o antígenos, reducir su gravedad o combatirlas.
¿Qué es un medicamento biológico nuevo?
Medicamento biológico que contiene una molécula con actividad biológica conocida, aún no registrada en Brasil, y que ha pasado por todas las etapas de producción (formulación, envase, liofilización, etiquetado, empaque, almacenamiento, control de calidad y liberación del lote de la nueva medicina biológica para su uso).
¿Qué es un medicamento genérico?
Es aquel que contiene el mismo principio activo, en la misma dosis y forma farmacéutica, y se administra por la misma vía y con la misma posología e indicación terapéutica del medicamento de referencia, presenta eficacia y seguridad equivalentes a la del medicamento de referencia, lo que los hace intercambiables. La intercambiabilidad, es decir, la sustitución segura del medicamento de referencia por su medicamento genérico se garantiza mediante pruebas de equivalencia terapéutica, que incluyen la comparación in vitro, a través de los estudios de equivalencia farmacéutica e in vivo, con estudios de bioequivalencia presentados a la Agencia Nacional de Vigilancia Sanitaria. Se los puede identificar con la franja amarilla en la que se lee "medicamento genérico". Además, en el envase deberá figurar la frase "medicamento genérico Ley n.º 9787/99". Debido a que los genéricos no tienen nombre de marca, lo que usted lee en el envase es el ingrediente activo del medicamento.
¿Qué es un medicamento nuevo?
El término "medicamento nuevo", sin ningún otro tipo de adjetivación, se utiliza en la práctica para referirse a los nuevos medicamentos con principios activos sintéticos y semisintéticos, asociados o no. Cuando se utiliza el término "medicamento nuevo" sin otro complemento no se refiere, por lo tanto, a productos biológicos, fitoterapéuticos, homeopáticos, los llamados medicamentos "específicos", medicamentos exentos de registro, ni a copias (genéricos y similares).
¿Qué es un medicamento de referencia?
Se trata de un producto innovador, registrado en el organismo federal encargado de la vigilancia sanitaria, y comercializado en el país, cuya eficacia, seguridad y calidad han sido demostradas científicamente al organismo federal competente en el momento del registro, de acuerdo con la definición del artículo XXII, artículo 3, de la Ley n.º 6360 de 1976 (modificada por la Ley n°. 9787 del 10 de febrero de 1999). La empresa interesada en registrar medicamentos genéricos o similares deberá utilizar obligatoriamente el medicamento de referencia contenido en las listas actuales disponibles en esta página (Lista A y B) de acuerdo con los requisitos específicos de la RDC 35 del 15 de junio de 2012, que establece los criterios para la indicación, inclusión y exclusión de medicamentos en la Lista de medicamentos de referencia.
¿Qué es un medicamento similar?
Es el que contiene el mismo o los mismos principios activos, presenta la misma concentración, forma farmacéutica, vía de administración, posología e indicación terapéutica y que es equivalente al medicamento registrado en el órgano federal responsable encargado de la vigilancia sanitaria, y solo puede diferir en características relacionadas con el tamaño y la forma del producto, el plazo de validación, el envase, el rótulo, los excipientes y el vehículo, y siempre debe identificarse mediante el nombre comercial o la marca.
¿Qué es un medicamento similar único de mercado?
Es el que está registrado como medicamento similar en Anvisa y es el único que se comercializa en el momento de la solicitud de indicación del medicamento de referencia. Este medicamento NO se podrá considerar un medicamento de referencia hasta que la compañía que lo registra cumpla con el artículo 6 de la Resolución, RDC n.° 134 del 29 de mayo de 2003, de acuerdo con el siguiente texto: "Art. 6: Con motivo de la primera renovación posterior a la publicación de la presente Resolución, los titulares de los registros de medicamentos clasificados como similares, únicos en el mercado (excepto los productos que hoy se encuentran registrados como nuevos y los que ya están definidos como de referencia), que expiran después del 1 de diciembre de 2004, deberán presentar como información complementaria:
I: En el caso de los principios activos individuales, un informe de ensayo clínico para demostrar la eficacia terapéutica o datos de la literatura que demuestren la eficacia y la seguridad mediante estudios clínicos publicados en revistas indexadas (Medline, Chemical Abstracts, Biosis, International Pharmaceutical Abstracts o Biological Abstratcts).
II: En el caso de asociaciones de medicamentos de productos sintéticos o semisintéticos o de dos o más presentaciones en el mismo envase para uso simultáneo o secuencial, además de la prueba de eficacia por principio activo o asociación, el solicitante deberá presentar lo siguiente:
a) Estudios de biodisponibilidad relacionada entre los principios activos asociados y cada principio activo individual que garantizan que la absorción y distribución de los principios activos en asociación no se vea afectada. Si no es posible, enviar la biodisponibilidad de cada principio activo individual.
b) Racionalidad de la asociación.
c) Estudios que demuestren que la asociación previene la aparición de resistencia microbiana en el caso de los antibióticos.
§ Único El marco de los productos de acuerdo con la primera oración de este artículo da derecho a no presentar pruebas de equivalencia farmacéutica y biodisponibilidad relativa en este momento y a ser destacados en el Compendio ANVISA de Signos Medicinales".
¿Qué es un producto farmacéutico intercambiable?
Es un equivalente terapéutico de un medicamento de referencia, cuya eficacia y seguridad han quedado esencialmente demostradas.
Un medicamento puede tener varias sustancias en su composición, pero solamente una o algunas de ellas tienen acción en el organismo o efecto terapéutico y se denominan principio activo o fármaco. Las demás sustancias que componen el medicamento y no tienen acción terapéutica en el organismo se denominan excipientes o vehículos y se utilizan para dar forma y volumen al medicamento. Los excipientes se utilizan en las formas farmacéuticas sólidas y los vehículos en las formas farmacéuticas líquidas.
¿Qué son las formas farmacéuticas?
Es el estado final de presentación que tienen los principios activos farmacéuticos después de una o más definiciones de operaciones farmacéuticas realizadas con la adición de excipientes apropiados o sin la adición de excipientes, con el fin de facilitar su uso y obtener el efecto terapéutico deseado, con características propias de una determinada vía de administración.
¿Cuáles son las formas farmacéuticas disponibles en el mercado?
En el mercado existe una variedad de formas farmacéuticas, dentro de ellas se encuentran las siguientes:
¿Por qué existen diferentes formas farmacéuticas?
Es una forma farmacéutica sólida que contiene una dosis única de uno o más principios activos, con o sin excipientes, que se obtiene a partir de la compresión de volúmenes uniformes de partículas. Puede haber una amplia variedad de tamaños y formatos, tener marcas en la superficie y estar recubierto o no.
¿Cuál es la diferencia entre comprimidos simples, recubiertos y de liberación prolongada?
Comprimido simple es un comprimido que no está recubierto y no tiene varias capas. Los excipientes utilizados no están destinados específicamente a modificar la liberación del principio activo en los fluidos digestivos.
Comprimido recubierto tiene una o más capas finas de recubrimiento, diseñadas para proteger el fármaco del aire o de la humedad, para fármacos con un olor y sabor desagradables, para mejorar la apariencia de las tabletas o para alguna otra propiedad que no sea alterar la velocidad o la extensión de la liberación del ingrediente activo.
Comprimido de liberación prolongada tiene excipientes que están destinados específicamente a modificar la liberación del principio activo en los fluidos digestivos.
¿Cuál es la diferencia entre cápsula, cápsula de liberación prolongada y cápsula de liberación atrasada?
Cápsula: es una forma farmacéutica sólida en la que el ingrediente activo o los excipientes están contenidos en una envoltura soluble dura o blanda de diversas formas y diversos tamaños, que suele contener una sola dosis del ingrediente activo. Generalmente se forma de gelatina, pero también puede ser de almidón o de otras sustancias.
Cápsula de liberación prolongada: en esta forma farmacéutica, se produce una liberación modificada que permite al menos una reducción de la frecuencia de la dosis en comparación con el medicamento presentado en forma de liberación inmediata. Se obtiene por medio de un diseño de formulación o método de fabricación especial.
Cápsula de liberación atrasada: en esta forma farmacéutica hay una liberación modificada que presenta una liberación atrasada del principio activo. La liberación atrasada se obtiene por medio de un diseño de formulación o método de fabricación especial. Las preparaciones gastroresistentes se consideran formas de liberación atrasada porque están destinadas a resistir el líquido gástrico y liberar el ingrediente activo en el líquido intestinal.
Crema: forma farmacéutica semisólida constituida por una emulsión, formada por una fase lipofílica y una fase acuosa. Contiene uno o más principios activos disueltos o dispersos sobre una base adecuada y se utiliza normalmente para su aplicación externa en la piel o las membranas mucosas.
Pomada: forma farmacéutica semisólida para su aplicación en la piel o las mucosas, que consiste de una solución o dispersión de uno o más principios activos en pequeñas proporciones sobre una base adecuada.
RAM es cualquier respuesta no intencionada, dañina o indeseable a un medicamento que se produce en las dosis que normalmente se utilizan en los hombres para la profilaxis, el diagnóstico, la terapia de la enfermedad o para la modificación de las funciones fisiológicas.
Los medicamentos pueden atravesar la placenta y tener efectos sobre el feto como malformaciones, cambios bioquímicos y de comportamiento. Durante el embarazo, la mujer debe evitar tomar medicamentos, alcohol, tabaco, cafeína y drogas en general. Si hay necesidad de tomar medicamentos durante el embarazo, el médico evaluará qué medicamento tiene el menor efecto adverso.
Los medicamentos que utiliza la madre pueden pasar al bebé a través de la leche materna. Algunos disminuyen la producción de leche, perjudican la alimentación y el desarrollo del bebé. Solo los indispensables deben ser utilizados en este período, luego de una cuidadosa evaluación por parte del médico.
El consejo de un prescriptor (médico o dentista) es esencial y le guiará de la mejor manera para tomar un medicamento. Sin embargo, muchos pacientes se preguntan si pueden tomar medicamentos con agua o leche, si pueden beber alcohol durante el período de tratamiento.
La mayoría de los medicamentos deben administrarse con agua y, en algunos casos, si se ingieren con jugo, leche o incluso bebidas alcohólicas, puede haber interferencia en su acción.
Por lo tanto, para tener éxito en el tratamiento es importante utilizar correctamente el medicamento recetado y no simplemente tomarlo. Para ello, los pacientes deben tener en cuenta que los medicamentos son diferentes entre sí, prestar atención a la cuestión de los intervalos entre dosis, manteniendo siempre el horario, deben seguir siempre las pautas recibidas del prescriptor y la información contenida en el prospecto.
Otro punto importante es el momento de la ingestión de los medicamentos, ya que debe hacerse en el período indicado. A menudo, el paciente al principio del tratamiento nota una mejoría y deja de tomar el medicamento, esto es un error bastante común y no se debe hacer sin antes consultar al médico.
Siempre se presentan dudas, así que consulte siempre al farmacéutico y al prescriptor, porque la eficacia de los medicamentos depende de su uso correcto.
¿Qué significa que haya una franja en el envase de los medicamentos?
El Ministerio de Salud ha clasificado los medicamentos según el grado de peligro que su uso incontrolado puede suponer para la salud del paciente. Para esta clasificación, el Ministerio adoptó los criterios de franjas en el etiquetado (cajas) de los medicamentos:
• Medicamentos de venta libre
Los medicamentos de venta libre no traen ninguna franja o marca especial. En general se utilizan para aliviar síntomas leves y temporales, como algunos analgésicos (combaten el dolor), antipiréticos (para la fiebre), antidiarreicos (para la diarrea) y antieméticos (para la ansiedad y el vómito). Aunque no es necesario presentar una receta para la compra de estos medicamentos, no se recomienda la automedicación, ya que ningún medicamento está libre de riesgos.
El consumo de medicamentos, incluso los de venta libre, sin vigilancia médica y sin la orientación del farmacéutico, puede acarrear graves riesgos para la salud.
• Con franja roja, se venden sin retención de la receta
Generalmente, se venden mediante la presentación de la receta. En la franja amarilla se encuentra impreso "Venta bajo prescripción médica". Estos medicamentos tienen contraindicaciones y pueden causar efectos secundarios graves.
• Con franja roja o negra con retención de recetas
Solo se pueden dispensar mediante una prescripción médica u odontológica. Estos medicamentos con franja requieren retención de la receta. Entre ellos se encuentran los medicamentos de control especial, los estupefacientes o psicotrópicos y otros medicamentos relacionados con ANVISA que pueden causar dependencia física o psicológica.
• Franja amarilla
Esta franja debe aparecer en el envase de los medicamentos genéricos y debe contener la inscripción G y Medicamento genérico escrito en azul, así como la frase "Medicamento genérico Ley n.° 9787/99".
Son aquellos que no provienen del fabricante original o que han sufrido cambios ilegales antes de ser suministrados al paciente.
• Nombre del producto, concentración, presentación farmacéutica.
• Número de lote con ocho dígitos.
• Fecha de vencimiento del producto.
• Nombre del farmacéutico responsable y su número de registro CRF (Consejo Regional de Farmacia), que debe estar en el mismo estado que el laboratorio del fabricante.
• Número de registro en ANVISA con 13 dígitos, siempre comenzando con el número 1.
• Sello de seguridad (para raspar) que debe ser raspado con metal (cobre) y debe figurar la palabra "Calidad" y el logotipo del fabricante. La identificación no debe estar borrosa o marcada.
• Número de servicio de atención al cliente.
• Etiquetas mal impresas, rasgadas, borradas o con cualquier información que parezca haber sido borrada o raspada.
• Folletos que parecen una copia.
• Envases aplastados, sellos rotos, etiquetas que se desprenden fácilmente o que se borran y desdibujan.
• Número de lote impreso en el embalaje secundario distinto del número impreso en el embalaje primario.
• Características organolépticas (olor, color, aspecto, formato del producto) alteradas.
• Nunca compre medicamentos en ferias y exposiciones.
• En el momento de la compra, dé preferencia a las farmacias y droguerías ya conocidas.
• Preste atención a las promociones y liquidaciones: los precios muy bajos pueden indicar que los medicamentos son de origen dudoso, no tienen garantía de calidad o incluso pueden ser robados.
• Siempre solicite la Factura de la farmacia o droguería y guárdela junto con el medicamento que está usando. Son la prueba de compra necesaria en caso de irregularidades.
• Si el medicamento no funciona como se indica o si la persona que lo toma no mejora, llame a su médico inmediatamente.
Los riesgos varían mucho, según del tipo de falsificación:
• Si el medicamento se ha diluido o está menos concentrado, la enfermedad que se debe tratar permanece o empeora, y puede significar un riesgo de muerte.
• Los cambios en la fórmula del producto de manera clandestina aumentan las posibilidades de intoxicación, ya que los productos adulterados pueden contener sustancias tóxicas.
• Los medicamentos reales robados de los laboratorios o las muestras gratuitas reenvasadas por las cuadrillas pierden las garantías de higiene y conservación, y pueden causar riesgos para la salud.
El lugar debe ser seguro y estar fuera del alcance de los niños para evitar la ingesta accidental de medicamentos. También debe protegerse de la luz directa, el calor y la humedad. Los lugares calientes, como la cocina, y los lugares húmedos, como el baño, no son adecuados para almacenar medicamentos. Pueden causar cambios en su composición, lo que disminuye su eficacia o causa efectos tóxicos, incluso si están dentro del período de validez.
También debemos tener en cuenta lo siguiente:
• Respetar la temperatura de conservación del medicamento, indicada en el prospecto o etiqueta del producto.
• Conservar el medicamento en el envase original.
•No quitar la etiqueta de los envases.
• Observar la fecha de vencimiento.
• No volver a utilizar los frascos de medicamentos usados para poner otros líquidos, ya que puede causar intoxicación.
• Evitar dejar el medicamento dentro del auto.
Es el plazo para la utilización del producto definido por el fabricante, en base a sus respectivas pruebas de estabilidad, manteniendo las condiciones de almacenamiento y transporte establecidas por el fabricante.
Cookies
Nuestro sitio web utiliza cookies para mejorar su experiencia de navegación. Al continuar su navegación, se considera su acuerdo con nuestra política de usarlos. Para obtener más información, consulte nuestra Política de cookies.
